Abbreviated QN
//tmp
(일단 내 수준에서 본 글 중에선) 양자,quantum 중에서 '원자 내 전자'에만 이 단어를 쓰는 것 같은데.....
Q: '양자상태'(란 단어를 봤는데) 를 수로 나타낸 것 ??? ('양자수'란 단어를 쓴다면, 그 중 원자,atom 내의 전자,electron의 양자상태만?)
 양자 상태 -> quantum state (띄어쓰기 안한 '양자상태'는 검색 안 됨.)
양자 상태 -> quantum state (띄어쓰기 안한 '양자상태'는 검색 안 됨.)
 양자상태
양자상태  양자 상태 - 2023-11 현재 둘 다 없음
양자 상태 - 2023-11 현재 둘 다 없음
...
 양자상태
양자상태  양자상태
양자상태  양자상태
양자상태
... 쓸만한 한국어결과가 적으므로
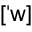 quantum_state
quantum_state  Quantum_state
Quantum_state 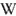 Quantum_state
Quantum_state  量子状態
量子状態
 quantum state
quantum state
양자상태,quantum_state - w, rr
세 개의 정수 양자수 n, ℓ, m이 있으며,
거기에 스핀,spin을 나타내는 반정수{ =반정수, 반정수
반정수  반정수
반정수  반정수
반정수  반정수 } 양자수 s가 하나 더....???
반정수 } 양자수 s가 하나 더....???
(일단 내 수준에서 본 글 중에선) 양자,quantum 중에서 '원자 내 전자'에만 이 단어를 쓰는 것 같은데.....
Q: '양자상태'(란 단어를 봤는데) 를 수로 나타낸 것 ??? ('양자수'란 단어를 쓴다면, 그 중 원자,atom 내의 전자,electron의 양자상태만?)
...
... 쓸만한 한국어결과가 적으므로
양자상태,quantum_state - w, rr
거기에 스핀,spin을 나타내는 반정수{ =반정수,
Contents
- 1. 주양자수 principal quantum number n
- 2. 각운동량양자수 angular momentum quantum number ℓ (=궤도양자수) (=방위양자수?)
- 3. 자기양자수 magnetic quantum number mℓ
- 4. 스핀양자수 spin quantum number ms
- 5. EBS 장인수 35강 8m
- 6. 박상희
- 7. Notes
- 8. 각 양자수 n, ℓ, mℓ에 대해 나타날 수 있는 궤도함수
- 9. 양자 페이지에서 가져옴 ; to merge
- 10. CHK... 이건 바로 위 '양자 페이지에서 가져옴'의 일부였음
- 11. 매우 밀접한 관련
- 12. 밀접한 관련
- 13. 관련
- 14. tmp links ko
- 15. tmp links en
2. 각운동량양자수 angular momentum quantum number ℓ (=궤도양자수) (=방위양자수?) ¶
ℓ의 범위: 0부터 n-1까지의 정수
오비탈의 모양을 규정
from 만화로쉽게배우는반도체
{
각운동량양자수 = AKA 궤도양자수.
외부에서 자기장을 걸어 주면 ℓ의 에너지 상태가 더욱 분리될 수 있으며, 그 수가 (2ℓ+1)개. 이 수가 자기양자수.
}
오비탈의 모양을 규정
| ℓ값 | 0 | 1 | 2 | 3 | 4 |
| 이름 | s | p | d | f | g |
from 만화로쉽게배우는반도체
{
각운동량양자수 = AKA 궤도양자수.
외부에서 자기장을 걸어 주면 ℓ의 에너지 상태가 더욱 분리될 수 있으며, 그 수가 (2ℓ+1)개. 이 수가 자기양자수.
}
"각운동량 양자수는 '방위 양자수(azimuthal quantum number)'라고도 불린다. 그러나 오래된 이름인 방위 양자수보다는 그 의미가 정확한 '각운동량 양자수'가 권장된다." (화학백과: 원자 오비탈, 미주 4)
5. EBS 장인수 35강 8m ¶
| 주양자수 | n | 전자의 에너지를 결정 | 1,2,3,…,n =K,L,M,… (shell=전자껍질) |
| 궤도양자수 | ℓ | 전자의 각운동량을 결정 | 0,1,2,…,n-1 = s,p,d,… (subshell=부껍질) |
| 자기양자수 | m | 각운동량의 성분을 나타냄 | 0,±1,±2,…,±ℓ |
| 스핀양자수 | 동일한 양자 상태에는 두 개의 전자만이 들어갈 수 있다. |
6. 박상희 ¶
| 주양자수 | n | 오비탈의 크기와 에너지 준위를 결정 보어 모형에서 전자껍질에 해당 | n=1: K n=2: L n=3: M... |
| 방위양자수, 부양자수 | ℓ | 오비탈의 3차원적 모양을 결정 | 주양자수가 n이면 방위양자수는 ℓ=0,1,…,(n-1)이며, ℓ=0,1,2,3,4에 대응하는 오비탈 기호는 s,p,d,f,g s: 구형, p: 아령형, d: 클로버형, f: 6개의 잎이 있는 클로버형 |
| 자기양자수 | m | 전자구름에 공간에서 어떤 방향으로 존재하는지 알려줌 | m=-ℓ~+ℓ 까지 (2ℓ+1)개의 정수값을 가짐 ℓ=0: m=0, ℓ=1: m=-1,0,+1 ℓ=2: m=-2,-1,0,+1,+2 |
| 스핀양자수 | s | 전자의 거동(자전)을 결정 | s=+½ 또는 s=-½ |
![[http]](/123/imgs/http.png) 4강 13분
4강 13분7. Notes 2020-11-25 ¶
{
n 주양자수 전자껍질 관련 (n=1,2,3,...) = (K L M ...) - (electron_shell)
ℓ 부양자수 오비탈 모양 관련 (ℓ=0,1,...,n-1) = (s p d f ...) - (오비탈,orbital)
s 전자의 스핀양자수 : ↑ 혹은 ↓로 표현하며, 각각 +1/2 and -1/2로도 표현.
즉 위의 세개는 정수,integer
n 주양자수 전자껍질 관련 (n=1,2,3,...) = (K L M ...) - (electron_shell)
ℓ 부양자수 오비탈 모양 관련 (ℓ=0,1,...,n-1) = (s p d f ...) - (오비탈,orbital)
s오비탈 방향이 없다
p오비탈 방향이 있다 - d 이후도?
m 자기양자수 오비탈 방향 관련 (m=-ℓ, ..., 0, ..., +ℓ)p오비탈 방향이 있다 - d 이후도?
s 전자의 스핀양자수 : ↑ 혹은 ↓로 표현하며, 각각 +1/2 and -1/2로도 표현.
즉 위의 세개는 정수,integer
이게 수소가 아닌 원자의 오비탈,orbital의 에너지준위,energy_level관련 맞나? CHK
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s ...
수소의 경우
1s < 2s = 2p < 3s = 3p = 3d < ...
CHK
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s ...
수소의 경우
1s < 2s = 2p < 3s = 3p = 3d < ...
CHK
원자에 있는 전자들의 양자수 요약 (59:58)
}
(from![[https]](/123/imgs/https.png) 김민경 일반화학1 강의)
김민경 일반화학1 강의)
| 이름 | 기호 | 허용 값 | 성질 |
| 주양자수 | n | 양의 정수(1, 2, 3, …) | 궤도함수 에너지(크기) |
| 부양자수 | ℓ | 0부터 n-1까지의 정수 | 궤도함수 모양(ℓ값 0, 1, 2, 3은 각각 s, p, d, f 궤도함수에 해당) |
| 자기양자수 | mℓ | -ℓ부터 +ℓ까지의 정수 | 궤도함수 배향(배향의 뜻은 orientation) |
| 스핀양자수 | ms | +½ 혹은 -½ | e- 스핀의 방향 |
(from
![[https]](/123/imgs/https.png) 김민경 일반화학1 강의)
김민경 일반화학1 강의)9. 양자 페이지에서 가져옴 ; to merge ¶
| 양자수의 이름 | 기호 | 범위(한계) | |
| Principal | 주양자수 | 임의의 양의 정수 | |
| Angular momentum | 각운동량양자수 | 정수 | |
| Magnetic | 자기양자수 | 정수 | |
| Spin | 스핀양자수 |
10. CHK... 이건 바로 위 '양자 페이지에서 가져옴'의 일부였음 ¶
CHK; tmp from http://contents.kocw.or.kr/KOCW/document/2016/chungang/hahnseungsoo/7.pdf
{
원자,atom 궤도 함수 (=오비탈,orbital?) 를 기술하는데 쓰이는 수
{
원자,atom 궤도 함수 (=오비탈,orbital?) 를 기술하는데 쓰이는 수
| 기호 | 명칭 | ||
| n | 주양자수 | 껍질 | 궤도함수의 에너지를 결정 |
| ℓ | 각운동량양자수 | 부껍질의 모양 | 궤도함수의 모양 및 부피를 설명 |
| mℓ | 자기양자수 | 부껍질의 방향 | 공간에서 궤도함수의 방향을 설명 |
| ms | 스핀양자수 | 전자의 거동 | 외부 자기장,magnetic_field의 존재에서 원자 방출 스펙트럼 선이 분리되는데서 발견. 두 가지 다른 스핀 상태 존재: +1/2 or -1/2 |
앞의 세 양자수는 Schroedinger equation의 해로부터 유도된 것
}
11. 매우 밀접한 관련 ¶
원자구조,atomic_structure 원자구조 atomic structure (curr see 원자,atom#s-2)
전자배치,electron_configuration
i.e.
원자,atom#s-2(원자구조)
전자배치,electron_configuration
i.e.
원자,atom#s-2(원자구조)
파울리_배타원리,Pauli_exclusion_principle : 한 원자 내에서, 양자수가 죄다 같은 전자는 있을 수가 없다. 고딩 화2 레벨에서 '한 칸에 최대 두 개의 전자만 들어간다'고 비유하는 것.
14. tmp links ko ¶
아래 블로그 일반물리 양자역학 시리즈 중 5,6,7번.
https://mathphysics.tistory.com/312?category=650370 (5번)
https://mathphysics.tistory.com/313?category=650370 (6번)
https://mathphysics.tistory.com/314?category=650370 (7번)
https://mathphysics.tistory.com/312?category=650370 (5번)
https://mathphysics.tistory.com/313?category=650370 (6번)
https://mathphysics.tistory.com/314?category=650370 (7번)

