AKA 반응속도상수 reaction rate constant
AKA 반응속도계수 reaction rate coefficient
AKA 반응속도계수 reaction rate coefficient
기호: 
반응속도상수  는 사실 온도에 따라 달라짐 - 온도에 대한 함수임.
는 사실 온도에 따라 달라짐 - 온도에 대한 함수임.
)
('상수'라는 표현에 현혹되지 말 것)
농도와 무관함을 강조하려고 이런 이름이 붙은건가? CHK
Q: 온도 말고 다른 변수도 있나?
농도와 무관함을 강조하려고 이런 이름이 붙은건가? CHK
Q: 온도 말고 다른 변수도 있나?
단위 ¶
단위: 반응차수(order)에 따라서 달라짐.
전체 반응 차수가 2일 경우,
rate = k [A]2
(속도 단위) = (속도 상수 단위) (농도 단위)2
(속도 상수 단위) = (속도 단위) / (농도 단위)2 = (M/s) / (M2) = M-1 s-1
}
0차반응의 속도상수 단위:
1차반응의 속도상수 단위: s-1
2차반응의 속도상수 단위: M-1 s-1
{1차반응의 속도상수 단위: s-1
2차반응의 속도상수 단위: M-1 s-1
전체 반응 차수가 2일 경우,
rate = k [A]2
(속도 단위) = (속도 상수 단위) (농도 단위)2
(속도 상수 단위) = (속도 단위) / (농도 단위)2 = (M/s) / (M2) = M-1 s-1
}
여러 전체 반응 차수에 대한 속도 상수 k의 단위
일반 식:
=\frac{\left(\frac{\rm L}{\rm mol}\right)^{\text{order}-1}}{(\text{unit of }t)})
s-1은 항상 있음이 보인다.
| 전체반응차수 | k의 단위(t는 초 단위) | 또는 |
| 0 | mol/L·s | mol L-1 s-1 |
| 1 | 1/s | s-1 |
| 2 | L/mol·s | L mol-1 s -1 |
| 3 | L2/mol2·s | L2 mol-2 s-1 |
속도상수의 factor ¶
rate constant  는 세 factor의 곱.
는 세 factor의 곱.
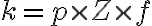
여기서
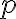 : steric factor - 충돌할 때의 방향과 관련있는 듯. 1보다 작음. collision model에서 예측할 수는 없음.
: steric factor - 충돌할 때의 방향과 관련있는 듯. 1보다 작음. collision model에서 예측할 수는 없음.
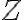 : collision frequency - 반응물의 단위농도에서 단위시간당 충돌 회수. kinetic theory of gases에서 꽤 정확히 계산 가능하나 책에서 다루진 않음.
: collision frequency - 반응물의 단위농도에서 단위시간당 충돌 회수. kinetic theory of gases에서 꽤 정확히 계산 가능하나 책에서 다루진 않음.
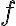 : 활성화에너지,activation_energy 이상의 에너지를 가진 분자의 비율? (fraction of collisions in which the energy of the colliding molecules is equal to or greater than Ea)
: 활성화에너지,activation_energy 이상의 에너지를 가진 분자의 비율? (fraction of collisions in which the energy of the colliding molecules is equal to or greater than Ea)
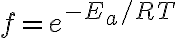 의 관계가 있음.
의 관계가 있음.
따라서
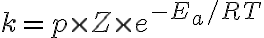
활성화에너지가 커질수록 속도상수는 작아짐.
(말이 되는게, 충돌하는 분자 비율 작아짐 → 반응이 느려짐)
(말이 되는게, 충돌하는 분자 비율 작아짐 → 반응이 느려짐)
See also 아레니우스_식,Arrhenius_equation
(Masterton)

