전자 한 개의 전하,electric_charge량:
(-)1.602…×10-19 C
(Nspire에서 _q)
전자 한 개의 질량,mass (me):(Nspire에서 _q)
9.109…×10-31 kg (Millikan)
이 둘의 비율은 (전하/질량 비) 비전하,specific_chargee/m = -1.76×108 C/g (Thomson)
전하,electric_charge와...Contents
- 1. 최외각전자,peripheral_electron
- 2. 원자가전자,valence_electron
- 3. 원자가전자(valence eletron)라고 하는 최외각전자(outer-shell electron)
- 4. 전자쌍,electron_pair
- 5. 전자껍질,electron_shell +전자배열/전자배치/원자구조
- 6. 자유전자,free_electron
- 7. 광전자 photoelectron
- 8. 소멸
- 9. 전자의 이동도? electron mobility
- 10. 전자가스 electron gas, 전자구름 electron cloud
- 11. 전자밀도 electron density = 전자농도 electron concentration ?
- 12. 전도전자 conduction electron
- 13. etc
1. 최외각전자,peripheral_electron ¶
최외각전자를 점으로 나타낸 루이스_구조,Lewis_structure가 있음
국내 사전에 나오는 peripheral electron이란 단어 잘 안쓰이는데? outermost electron이 더 많이 쓰이고 사실 최외각전자라는 말 자체가 별로 안 쓰임.
나무위키는 최외각전자와 원자가전자를 구분....
2023-04-07
kps는 {valence electron 원자가 전자, 가전자, 최외각 전자} ... 구분 없음. via https://www.kps.or.kr/content/voca/search.php?page=2&et=en&find_kw=valence
kps는 {valence electron 원자가 전자, 가전자, 최외각 전자} ... 구분 없음. via https://www.kps.or.kr/content/voca/search.php?page=2&et=en&find_kw=valence
2. 원자가전자,valence_electron ¶
최외각 전자 중 화학반응에 참여할 수 있는 전자
18족 원소의 경우 최외각 전자는 8개이지만 이 전자들은 반응에 참여하지 않기 때문에 원자가 전자는 0개
N의 최외각전자 5개, 원자가전자 3개
원자들이 화학결합,chemical_bond할 때 원자가전자
원자의 가장 바깥 궤도함수의 전자. 화학결합,chemical_bond에서 중요한 역할.
 원자가전자 여긴 원자가전자/최외각전자를 구분하는데 어디가 옳은건지. QQQQ
원자가전자 여긴 원자가전자/최외각전자를 구분하는데 어디가 옳은건지. QQQQ
이렇게 최외각전자와 원자가전자를 구별하지 않는 서술이 많다. CHK
가전자가 없는 원자는 화학적으로 안정하다.
....related: 컨덕티버티,conductivity 도체,conductor
비활성기체 (He, Ne, Ar 등)
다른 원자에 전자를 주거나 받지 않아도 안정하므로, 부도체.
가전자가 있는 전자는 화학적으로 불안정하다.다른 원자에 전자를 주거나 받지 않아도 안정하므로, 부도체.
화학적으로 활발.
원자는 가전자를 다른 원자에 주거나, 다른 원자로부터 받아서 안정된 상태가 되려고 한다. 이 때문에 가전자가 있는 원자는 화학적으로 활발해지며 전도성을 가짐.
....CHK 특히 부도체 전도성 관련.원자는 가전자를 다른 원자에 주거나, 다른 원자로부터 받아서 안정된 상태가 되려고 한다. 이 때문에 가전자가 있는 원자는 화학적으로 활발해지며 전도성을 가짐.
....related: 컨덕티버티,conductivity 도체,conductor
가전자는 열,heat, 빛,light, 전압,voltage의 영향으로 자유전자가 되기 쉽다. 하나의 가전자가 튀어 나가면 양이온이 됨. 궤도 밖으로 튀어 나간 전자는 자유전자,free_electron가 됨.
4. 전자쌍,electron_pair ¶
(AKA Lewis pair)
공유 전자쌍: 원자의 최외각전자 중 공유결합에 참여한 전자쌍
비공유 전자쌍: 원자의 최외각전자 중 공유결합에 참여하지 않은 전자쌍
비공유 전자쌍: 원자의 최외각전자 중 공유결합에 참여하지 않은 전자쌍
5. 전자껍질,electron_shell +전자배열/전자배치/원자구조 ¶
| n | 껍질명 | the quota of electrons for each shell |
| 1 | K | 2 |
| 2 | L | 8 |
| 3 | M | 8/18 |
| 4 | N | 8/18/32 |
| 5 | O | 8/18 |
| 6 | P | 8/18 |
| 7 | Q | 8 |
n은 주양자수(principal quantum number). K, L, M, …은 ‘X선 연구 전통’을 따른 것이라 함.
그런데 가장 바깥 껍질의 최대는 8이라 함.
이렇게 되는 이유? 설명?
(Schaum Basic Electricity 2e p3)
----
The maximum number of electrons that can fit in any shell n is given by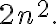
가장 바깥쪽 껍질은 원자가 껍질(valence shell, 최외각) ( 최외각이 원자가랑 같다고 함. ) 원자가,valence
원자가껍질은 최대 8개의 전자만 가질 수 있음.
가장 바깥쪽 껍질은 원자가 껍질(valence shell, 최외각)
최외각이 원자가랑 같다고?
The number of electrons in the valence shell is a periodic property.
1 Maximum number of electrons
2 Maximum number as outermost shell
The maximum number of electrons that can fit in any shell n is given by
가장 바깥쪽 껍질은 원자가 껍질(valence shell, 최외각) ( 최외각이 원자가랑 같다고 함. ) 원자가,valence
원자가껍질은 최대 8개의 전자만 가질 수 있음.
최외각이 원자가랑 같다고?
The number of electrons in the valence shell is a periodic property.
| 껍질 번호 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 최대 전자 수 1 | 2 | 8 | 18 | 32 | 50 | 72 | 98 |
| 최외각껍질이 담는 최대 전자 수? 2 | 2 | 8 | 8 | 8 | 8 | 8 | 8 |
2 Maximum number as outermost shell
Why do electron shells have set limits ? (1999)
http://www.madsci.org/posts/archives/1999-03/921736624.Ch.r.html
http://www.madsci.org/posts/archives/1999-03/921736624.Ch.r.html
AKA 전자각(殼=shell). 이렇게 한자를 쓰는 곳에는 subshell은 부각이다.
부껍질(subshell)의 사용(차지, occupancy)
| 부껍질 타입 | 오비탈 수 | 최대 전자 수 | |
| s | 0 | 1 | 2 |
| p | -1,0,1 | 3 | 6 |
| d | -2,-1,0,1,2 | 5 | 10 |
| f | -3,-2,-1,0,1,2,3 | 7 | 14 |
(Schaum Begninning Chem p29 Table 3.4 Occupancy of Subshells)
이것은 원소의 화학적 주기성과 큰 관련.
6. 자유전자,free_electron ¶
2020-10-22: '자유전하 free charge' 내용. CHK, CLEANUP, MERGE mainly to 자유전자
{
{
자유전하와 비슷한 말인듯? :
좀 다르지만 약간 비슷? :
관련:
}
좀 다르지만 약간 비슷? :
관련:
}
10. 전자가스 electron gas, 전자구름 electron cloud ¶
금속,metal의 금속결합,metallic_bond에서.
금속 원자는 단지 몇 개의 가전자,valence_electron를 가지고 있는데 이것들은 떼어내기가 어렵지 않다.
금속 원자가 결합하여 고체,solid를 만들 때, 가전자들이 개개 원자로부터 이탈해서 모든 이온에 의해 집단적으로 공유된다. 그래서 가전자들이 탈국부화되어서(delocalized) 이온들 사이의 공간으로 스며드는 전자가스(electron gas)나 전자구름(electron cloud)을 형성한다. 이 전자가스의 음전하와 금속 이온 사이의 인력은 처음 각 원자로부터 가전자를 제거하는 데 필요한 에너지보다 더 큰 에너지를 가진다. 그래서 금속 내 결합은 본질적으로 고정된 금속 이온과 이온들 사이를 자유로이 유동하는 전자들 사이의 인력에서 비롯된다.
(Kasap 4e ko p11)
금속 원자는 단지 몇 개의 가전자,valence_electron를 가지고 있는데 이것들은 떼어내기가 어렵지 않다.
금속 원자가 결합하여 고체,solid를 만들 때, 가전자들이 개개 원자로부터 이탈해서 모든 이온에 의해 집단적으로 공유된다. 그래서 가전자들이 탈국부화되어서(delocalized) 이온들 사이의 공간으로 스며드는 전자가스(electron gas)나 전자구름(electron cloud)을 형성한다. 이 전자가스의 음전하와 금속 이온 사이의 인력은 처음 각 원자로부터 가전자를 제거하는 데 필요한 에너지보다 더 큰 에너지를 가진다. 그래서 금속 내 결합은 본질적으로 고정된 금속 이온과 이온들 사이를 자유로이 유동하는 전자들 사이의 인력에서 비롯된다.
(Kasap 4e ko p11)
(단 전자구름은 오비탈,orbital의 비유로도 쓰임...)
12. 전도전자 conduction electron ¶
MKLINK
도체,conductor
반도체,semiconductor
전도띠,conduction_band - curr at 띠,band#s-3.2
페르미_에너지,Fermi_energy
전기전도도 = 컨덕티버티,conductivity
conduction - 전도,conduction?
도체,conductor
반도체,semiconductor
전도띠,conduction_band - curr at 띠,band#s-3.2
페르미_에너지,Fermi_energy
전기전도도 = 컨덕티버티,conductivity
conduction - 전도,conduction?


![[https]](/123/imgs/https.png)