Difference between r1.1 and the current
@@ -1,15 +1,36 @@
[[삼투,osmosis]]: 농도가 묽은 용액의 용매 분자가 더 진한 용액 쪽으로 흘러들어가는 것{
'''삼투, 삼투 현상'''
'''삼투압''': 삼투현상이 일어나지 않게 하기 위해 농도가 진한 용액에 가하는 추가 압력
반투막으로 분리되어 있는 서로 다른 두 [[용액,solution]]에서???
용매는 통과할 수 있고?? - CHK
용질은 투과할 수 없는 반투막(semipermeable_membrane)을 통해, 농도가 낮은 곳에서 높은 곳으로 용매가 이동하는 것
반투과성 막(semipermeable membrane)을 사이에 두고 서로 다른 [[농도,concentration]]의 두 용액이 있을 때 용매가 이동하면서
...
[[압력,pressure]]의 [[차이,difference]]가 생기는데 그것이 [[삼투압,osmotic_pressure]] CHK
Sub: [[삼투압,osmotic_pressure]]
}
'''삼투압''':
삼투현상이 일어나지 않게 하기 위해 농도가 진한 용액에 가하는 추가 압력.
[[삼투,osmosis]] 현상을 멈추는 데 필요한 [[압력,pressure]].
묽은 용액의 삼투압 π는 [[몰농도,molarity]] C와 [[절대온도]] T에 비례
$\pi=CRT$
용액 V(L)에 비휘발성이고 비전해질인 용질이 ''n''(mol) 녹아 있을 경우, 몰농도 C=n/V이므로 위의 식을 이상기체상태방정식과 비슷하게 나타낼 수 있음
이것은 이상기체상태방정식에서 유도할 수 있다고.
[[용액,solution]] V(L)에 비휘발성이고 비전해질인 [[용질,solute]]이 $n$ (mol) 녹아 있을 경우, [[몰농도,molarity]] C=n/V이므로 위의 식을 이상기체상태방정식과 비슷하게 나타낼 수 있음
$\pi V=nRT$(van't Hoff의 법칙)
{
[[반트호프_법칙]] van 't Hoff equation [[WpEn:Van_%27t_Hoff_equation]] [[WpKo:판트호프_방정식]] ... Ggl:"van't Hoff" Ndict:"van't Hoff" KcsE:hoff KpsE:hoff
}
----
Up: [[삼투,osmosis]] [[압력,pressure]]
반투막으로 분리되어 있는 서로 다른 두 용액,solution에서???
용매는 통과할 수 있고?? - CHK
용질은 투과할 수 없는 반투막(semipermeable_membrane)을 통해, 농도가 낮은 곳에서 높은 곳으로 용매가 이동하는 것
용매는 통과할 수 있고?? - CHK
용질은 투과할 수 없는 반투막(semipermeable_membrane)을 통해, 농도가 낮은 곳에서 높은 곳으로 용매가 이동하는 것
반투과성 막(semipermeable membrane)을 사이에 두고 서로 다른 농도,concentration의 두 용액이 있을 때 용매가 이동하면서
Sub: 삼투압,osmotic_pressure
...
압력,pressure의 차이,difference가 생기는데 그것이 삼투압,osmotic_pressure CHKSub: 삼투압,osmotic_pressure
}
용액,solution V(L)에 비휘발성이고 비전해질인 용질,solute이 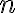 (mol) 녹아 있을 경우, 몰농도,molarity C=n/V이므로 위의 식을 이상기체상태방정식과 비슷하게 나타낼 수 있음
(mol) 녹아 있을 경우, 몰농도,molarity C=n/V이므로 위의 식을 이상기체상태방정식과 비슷하게 나타낼 수 있음

(van't Hoff의 법칙)
{
반트호프_법칙 van 't Hoff equation Van_'t_Hoff_equation
Van_'t_Hoff_equation  판트호프_방정식 ...
판트호프_방정식 ...  van't Hoff
van't Hoff  van't Hoff
van't Hoff  hoff
hoff  hoff
hoff
}
{
반트호프_법칙 van 't Hoff equation
}

