기호: 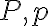
정의:
단위: 1 Pa = 1 N/m2
단위: 1 Pa = 1 N/m2
여기서 힘은 면의 수직 방향으로의 스칼라 값만 생각한다. 따라서 압력은 벡터량이 아니라 스칼라량이다. (방향을 생각하지 않는다)
1. 기압 ¶
AKA 대기압, atmospheric pressure
먼저 1 hPa = 100 Pa
Pa 외의 단위:
1 기압 = 1 atm
= 760 mmHg = 760 torr
= 101325 Pa = 1013.25 hPa = 101.325 kPa
= 1.013 × 105 Pa ≒ 105 Pa
1 bar = 105 Pa= 101325 Pa = 1013.25 hPa = 101.325 kPa
= 1.013 × 105 Pa ≒ 105 Pa
기압계: barometer
6. (기체의) 분압, 부분 압력, partial pressure ¶
화학,chemistry에서, 기체,gas 특정 성분만 있다고 가정했을 때 그 압력
The partial pressure of a gas is the pressure that the gas would exert if it were alone in the container.
The partial pressure of a gas is the pressure that the gas would exert if it were alone in the container.
돌턴의 부분 압력 법칙 Dalton’s law of partial pressures
화학page에서 옮겨옴. TOMERGE
{
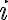 유형의 기체가
유형의 기체가 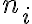 몰 있을 때 분압은 다음과 같다.
몰 있을 때 분압은 다음과 같다.

따라서 압력은
\frac{RT}{V}=n\frac{RT}{V})
따라서
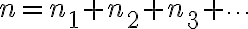
이것을 돌턴의 부분압력 법칙(Dalton's law of partial pressure)이라 한다.
{
"서로 반응하지 않는 혼합 기체의 전체 압력은 각 성분 기체의 부분 압력의 합과 같다."
7. 증기압, 증기압력, vapor pressure ¶
증기압력내림
증기압 곡선
클라우지우스-클라이페이롱 식(Clausius-Clapeyron equation)
라울 법칙(Raoult's law)
헨리 법칙(Henry's law)
- 비휘발성 용질이 용해된 용액은, 용질이 용매의 기화를 방해하므로, 순수한 용매보다 용액의 증기 압력이 낮아짐
- 용액에서 용질이 차지하는 몰분율,mole_fraction에 비례
related:- 용액에서 용질이 차지하는 몰분율,mole_fraction에 비례
증기압 곡선
클라우지우스-클라이페이롱 식(Clausius-Clapeyron equation)
라울 법칙(Raoult's law)
헨리 법칙(Henry's law)
Up:
9. 일과의 관계 ¶
압력과 일,work의 관계
압력이 한 일 Work done by pressure
면적 A인 표면에 압력 P로 눌러서 표면과 수직으로 거리 Δx만큼 눌렀다면,
(그 때문에 부피 변화가 ΔV = A Δx)
압력이 한 일은
면적 A인 표면에 압력 P로 눌러서 표면과 수직으로 거리 Δx만큼 눌렀다면,
(그 때문에 부피 변화가 ΔV = A Δx)
압력이 한 일은
Work = P A Δx = P ΔV
// copied from 유체역학,fluid_mechanics(curr goto 물리학,physics#s-6)from ![[http]](/123/imgs/http.png) this image
this image
기체가 들어있는 피스톤에서
W의 부호,sign는 ΔV>0 기체팽창할때 ΔV<0 기체압축될때 .. 항상이런건가? CHK
![[http]](/123/imgs/http.png) this image
this image기체가 들어있는 피스톤에서
압력 = 힘 / 면적, P = F / A
이므로,힘 = 압력 × 면적, F = P A
따라서 피스톤이 Δx만큼 움직일 때 기체의 부피가 ΔV만큼 변한다면, 기체가 한 일 W는W = F Δx = P A Δx = P ΔV
Q:W의 부호,sign는 ΔV>0 기체팽창할때 ΔV<0 기체압축될때 .. 항상이런건가? CHK


![[https]](/123/imgs/https.png)