기호 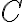
물체의 온도를 1 °C (1 K) 올리는 데 필요한 열,heat의 양
따라서 물체의 양에 비례하는데,
양의 단위가 mol이면

ex. 물 5.00 g 온도가 1.00 K 상승할 때 209 J이 필요. 따라서 물의 비열은
(1.00 {\rm K})}=4.18{\rm J/g\cdot K})
따라서 물체의 양에 비례하는데,
양의 단위가 mol이면
물질 1 mol의 열용량은 몰열용량 Cm molar heat capacity
양의 단위가 kg이면(바로 아래 곱하기 1000?)
양의 단위가 g이면물질 1 g의 열용량은 비열용량 Cs specific heat capacity 또는 간단히 비열 specific heat
(비열) = (열전달량) / ((물질의 그램수) × (온도 변화))ex. 물 5.00 g 온도가 1.00 K 상승할 때 209 J이 필요. 따라서 물의 비열은
열이
 이므로,
이므로,
열용량은
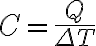
식에서 보이듯, 열용량(C)이 클 수록 온도변화(ΔT)가 작다.
Compare 비열,specific_heat(= 비열용량 = specific heat capacity)

