열역학적 계 (thermodynamic system)
고립계에서는,
계,system : 관심의 대상이 되는 부분
주위(surroundings): 계를 제외한 나머지 부분
계와 주위를 합쳐 우주(thermodynamic universe).
| 영어로 | 에너지 교환 | 물질 교환 | ||
| 고립계 | isolated system | × | × | |
| 닫힌계 | closed system | ○ | × | =밀폐계 |
| 열린계 | open system | ○ | ○ | =개방계 |
고립계에서는,
계,system : 관심의 대상이 되는 부분
주위(surroundings): 계를 제외한 나머지 부분
계와 주위를 합쳐 우주(thermodynamic universe).
(논외로, 일반물리 역학부분에서는 계의 에너지를 다룰 때
계(system)
경계(system boundary)
환경(environment)
이렇게 나누는 것을 봤는데... 이런 분류의 차이의 이유는 무엇인지. 아울러,
고립계: 에너지가 계의 경계를 넘을 수 있는 경우 (→ 에너지 보존 법칙 성립)
비고립계: 에너지가 계의 경계를 넘지 않는 경우
이것은 위의 표와도 일치. 즉, '고립'의 주어는 에너지,energy.)
계(system)
경계(system boundary)
환경(environment)
이렇게 나누는 것을 봤는데... 이런 분류의 차이의 이유는 무엇인지. 아울러,
고립계: 에너지가 계의 경계를 넘을 수 있는 경우 (→ 에너지 보존 법칙 성립)
비고립계: 에너지가 계의 경계를 넘지 않는 경우
이것은 위의 표와도 일치. 즉, '고립'의 주어는 에너지,energy.)
계는 자체의 내부에너지,internal_energy를 갖고 있다.
계와 주위 사이에 벽(wall)이 있는데,
경계(boundary)와 같은 말?
- diathermal (열을 통과시키는 벽)
- adiabatic (단열 벽)
경계(boundary)와 같은 말?
2. Topics ¶
열,heat : 뜨거운 물체에서 차가운 물체로 이동하는 에너지 - 이동하는 만큼의 에너지 자체? 에너지의 흐름을 수치화한 것? 에너지 흐름 '현상'? 에너지 자체일 듯 한데... CHK
온도,temperature T
비열,specific_heat c
열용량,heat_capacity C
엔탈피,enthalpy H
엔트로피,entropy S
내부에너지,internal_energy U
자유에너지,free_energy G
온도,temperature T
비열,specific_heat c
열용량,heat_capacity C
엔탈피,enthalpy H
엔트로피,entropy S
내부에너지,internal_energy U
자유에너지,free_energy G
| 비열 | c | =비열용량 |
| 열용량 | C | |
| 열량 | Q | =열 |
비가역반응 irreversible process
3.1. 제 0법칙 ¶
A와 B가 열평형(thermal equilibrium)이고,
B와 C가 열평형이면
A와 C도 열평형이다.
B와 C가 열평형이면
A와 C도 열평형이다.
이때 B는 온도계(thermometer) 역할을 한다.
다른 말로는,
'온도라는 것이 있다'는 법칙.
'온도라는 것이 있다'는 법칙.
3.2. 제 1법칙 ¶
다른 말로는 에너지보존법칙.
자연계에서 에너지의 총량은 일정하다는 법칙.
우주의 에너지의 양은 변하지 않는다.
에너지는 보존되며 새롭게 만들어지지도 파괴되지도 않는다.
에너지는 창조되지도 파괴되지도 않는다. 우주의 총 에너지는 일정하다. 어떤 계가 에너지를 잃으면 그 주위가 에너지를 얻는다. vice versa.
내부 에너지를 정의한다. (see 내부에너지,internal_energy)
자연계에서 에너지의 총량은 일정하다는 법칙.
우주의 에너지의 양은 변하지 않는다.
에너지는 보존되며 새롭게 만들어지지도 파괴되지도 않는다.
에너지는 창조되지도 파괴되지도 않는다. 우주의 총 에너지는 일정하다. 어떤 계가 에너지를 잃으면 그 주위가 에너지를 얻는다. vice versa.
내부 에너지를 정의한다. (see 내부에너지,internal_energy)
TOCLEANUP
외부와 계 사이에 일,work을 주고받는걸 상상해 본다.
일(W):
외부와 계 사이에 일,work을 주고받는걸 상상해 본다.
일(W):
시스템이 하는 일 W > 0
시스템이 받는 일 W < 0
시스템이 받는 일 W < 0
--Q--> [ System ] --W-->
그러면 시스템의 에너지의 변화는 +Q-W = 내부에너지의 변화 ΔU = Uf - Ui
ΔU = Uf - Ui = Q - W
복습
Pictorially,
Heat Work
+ +--------+ +
----------->| System |----------->
- | | -
<-----------| |<-----------
+--------+
Sign convention
- Heat
- Positive(+) when the system gains
- Negative(-) when the system loses
- Positive(+) when the system gains
- Work
- Positive(+) when done by the system
- Negative(-) when done on the system
- Positive(+) when done by the system
| Type | Work | 1st Law |
| Isobaric(P const.) | ||
| Isochoric(V const.) | ||
| Isothermal(T const.) | ||
| Adiabatic(Q=0) |
ΔE = Q + W (화학)
계가 받은 열(Q)과 계에게 해준 일(W)의 합을 계의 에너지 변화량(ΔE)이라 한다.
여기서 외부 압력에 대해 부피가 변하는 일 외에 다른 일이 없다면,
계가 받은 열(Q)과 계에게 해준 일(W)의 합을 계의 에너지 변화량(ΔE)이라 한다.
여기서 외부 압력에 대해 부피가 변하는 일 외에 다른 일이 없다면,
일은 W = -PΔV, 따라서 ΔE = Q - PΔV
ΔU = Q - W (물리)3.3. 제 2법칙 ¶
1법칙은 가능하냐 불가능하냐를 따진다. (possibility) 하지만 제 2법칙은 자발적으로 가능한지를 따진다. (spontaneity)
Clausius의 표현: 열은 자발적으로 낮은온도에서 높은온도로 흐를 수 없다.
Kelvin의 표현: 높은 온도에서 열을 받아서 100% 일로 변환할 수 있는 열기관은 없다.
Boltzmann의 표현: 우주의 엔트로피는 줄어들 수 없다. (같거나 증가한다)
QC
QH
열기관의 효율QH
- 가역반응(reversible process)
carnot refrigerator
4. 복습 ¶
0th law: There exists temperature.
1st law: Energy conservation: ΔU = Q - W
2nd law: Entropy of the universe can not decrease.
3rd law: It is not possible to achieve T = 0 K in a finite number of steps.
1st law: Energy conservation: ΔU = Q - W
2nd law: Entropy of the universe can not decrease.
3rd law: It is not possible to achieve T = 0 K in a finite number of steps.
5.1. 1법칙 ¶
tmp from ebs 장인수
기체가 하는 일
피스톤 단면적 A, 피스톤이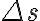 만큼 밀림
만큼 밀림
\Delta s=P\Delta V)
피스톤 단면적 A, 피스톤이
P-V그래프의 밑넓이가 일이라 한다. 따라서 위의 내용
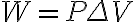
을 일반화하면
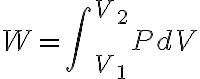
인 것 같다. CHK
일의 부호,sign
압력(P)는 항상 양이라고 한다. (음압같은건 그럼 P<0으로 놓으면 안되고 ΔV < 0??)
W > 0 : W = P ΔV 에서 ΔV > 0 (부피 증가) : 기체가 외부로 일을 했다
W < 0 : W = P ΔV 에서 ΔV < 0 (부피 감소) : 기체가 일을 받았다
W = 0 : ΔV = 0 (부피 일정) : 일을 안했다
압력(P)는 항상 양이라고 한다. (음압같은건 그럼 P<0으로 놓으면 안되고 ΔV < 0??)
W > 0 : W = P ΔV 에서 ΔV > 0 (부피 증가) : 기체가 외부로 일을 했다
W < 0 : W = P ΔV 에서 ΔV < 0 (부피 감소) : 기체가 일을 받았다
W = 0 : ΔV = 0 (부피 일정) : 일을 안했다
정리하면
| + | - | 0 | |
| Q 열을 | 흡수 | 방출 | 단열 |
| ΔU | 증가 | 감소 | 일정 |
| W 일을 | 했다 | 받았다 | 안했다 |
5.5. 열역학 과정: 단열변화 ¶
단열이란 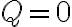
단열팽창
Q=ΔU+W 에서 Q=0, W>0(∵ W=PΔV인데 ΔV>0) 이므로 ΔU<0
즉 온도 감소함.
냉각 방법으로 아주 많이 언급됨. 압축했다가 작은 구멍으로 팽창시키는 것으로.
단열압축즉 온도 감소함.
냉각 방법으로 아주 많이 언급됨. 압축했다가 작은 구멍으로 팽창시키는 것으로.
Q=ΔU+W 에서 Q=0, W<0이므로 ΔU>0
즉 온도 증가.
즉 온도 증가.
6. 열화학,thermochemistry ¶
열역학의 분야. 화학적/물리적 변화에 수반되는 열을 다룸.
| 발열의 발열성의 exothermic |
| 흡열의 흡열성의 endothermic |
endo- : 안으로
exo- : 밖으로
7. Links ¶
필기
https://blog.naver.com/hafs_snu/220732342432 1법칙, 각 과정(process)
https://blog.naver.com/hafs_snu/220732342641 2법칙, 카르노, 엔트로피
https://blog.naver.com/hafs_snu/220732342432 1법칙, 각 과정(process)
https://blog.naver.com/hafs_snu/220732342641 2법칙, 카르노, 엔트로피
일반화학의 열역학 내용 요약정리
https://nate9389.tistory.com/1344?category=1024960
https://nate9389.tistory.com/1345?category=1024960
https://nate9389.tistory.com/1344?category=1024960
https://nate9389.tistory.com/1345?category=1024960
Related:
Misc: 이 학문은 약간 오싹한 느낌이 드는 게, 우주 종말의 한 가능성을 예상할 수 있는 수단이기 때문. (thermodynamic heat death of the universe)
Misc: 이 학문은 약간 오싹한 느낌이 드는 게, 우주 종말의 한 가능성을 예상할 수 있는 수단이기 때문. (thermodynamic heat death of the universe)


![[https]](/123/imgs/https.png)