기호: 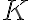
평형상태를 예측하게 해 줌.
해당 온도에서 반응이 어느 정도까지 생성물로 진행될지에 대한 척도.
해당 온도에서 반응이 어느 정도까지 생성물로 진행될지에 대한 척도.
2. 평형페이지에서 가져옴. TOMERGE ¶
{
예. 25 °C 에서 가역반응 N2O4(g) ⇄ 2NO2(g)에서 [NO₂]2 / [N₂O₄] 값은 4.63×10-3으로 거의 일정. 평형상수는
![$K=\frac{[\textrm{NO_2}]^2}{\textrm{[N_2O_4]}}=4.63\times 10^{-3}$ $K=\frac{[\textrm{NO_2}]^2}{\textrm{[N_2O_4]}}=4.63\times 10^{-3}$](/123/cgi-bin/mimetex.cgi?\Large K=\frac{[\textrm{NO_2}]^2}{\textrm{[N_2O_4]}}=4.63\times 10^{-3})
좀더 일반적으로, 반응
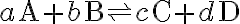
에서 평형상수는
![$K=\frac{[{\rm C}]^c [{\rm D}]^d}{[{\rm A}]^a [{\rm B}]^b}$ $K=\frac{[{\rm C}]^c [{\rm D}]^d}{[{\rm A}]^a [{\rm B}]^b}$](/123/cgi-bin/mimetex.cgi?\Large K=\frac{[{\rm C}]^c [{\rm D}]^d}{[{\rm A}]^a [{\rm B}]^b})
}
3. tmp to mv.... 평형상수 K, 반응지수 Q 비교 ¶
이하 고딩 화II
평형상수 K
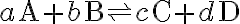 (a~d: 반응계수)
(a~d: 반응계수)
에서 평형상수 K는
![$K=\frac{[{\rm C}]^c [{\rm D}]^d}{[{\rm A}]^a [{\rm B}]^b}$ $K=\frac{[{\rm C}]^c [{\rm D}]^d}{[{\rm A}]^a [{\rm B}]^b}$](/123/cgi-bin/mimetex.cgi?\Large K=\frac{[{\rm C}]^c [{\rm D}]^d}{[{\rm A}]^a [{\rm B}]^b})
([A], [B], [C], [D]는 각각 A, B, C, D의 평형 농도(M))
// mv up
([A], [B], [C], [D]는 각각 A, B, C, D의 평형 농도(M))
반응지수 Q
![$Q=\frac{[{\rm C}]^c [{\rm D}]^d}{[{\rm A}]^a [{\rm B}]^b}$ $Q=\frac{[{\rm C}]^c [{\rm D}]^d}{[{\rm A}]^a [{\rm B}]^b}$](/123/cgi-bin/mimetex.cgi?\Large Q=\frac{[{\rm C}]^c [{\rm D}]^d}{[{\rm A}]^a [{\rm B}]^b})
([A], [B], [C], [D]는 각각 A, B, C, D의 현재 농도(M))
// fork to 반응지수,reaction_quotient
평형상수식에 반응물과 생성물의 현재농도(M)을 대입하여 구한 값
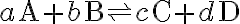 (a~d: 반응계수)
(a~d: 반응계수)
에서 반응지수 Q는([A], [B], [C], [D]는 각각 A, B, C, D의 현재 농도(M))
K, Q를 비교해 반응의 진행방향 예측
반응의 방향과 Q와 K의 상대적 크기
Q<K 정반응 우세, 오른쪽으로 진행
Q>K 역반응 우세, 왼쪽으로 진행
Q=K 평형
| Q<K | 정반응 우세 |
| Q=K | 평형 |
| Q>K | 역반응 우세 |
반응의 방향과 Q와 K의 상대적 크기
Q<K 정반응 우세, 오른쪽으로 진행
Q>K 역반응 우세, 왼쪽으로 진행
Q=K 평형

