아레니우스_식,Arrhenius_equation (rev. 1.1)
=Ae^{-E_a/RT})
CHK
A :
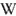 Pre-exponential_factor
Pre-exponential_factor = A factor
= frequency factor (일차반응(first-order reaction)에서는 단위가 s
-1 이라서 붙은 이름)
관련: Z는
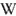 Collision_frequency
Collision_frequency
R : 기체상수
T : 절대온도
k : 반응속도상수(reaction rate constant or reaction rate coefficient)

: 속도상수
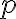
: 반응하기에 적절한 배향을 가지는 충돌분율
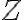
: 충돌 빈도
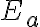
: 활성화에너지
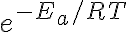
: 반응하기에 충분한 에너지를 가지는 충돌분율
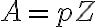
: 잦음률(frequency factor) 또는 지수 앞 인자
속도상수는
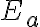
가 증가할 때 감소하고,
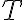
가 증가할 때 증가한다.
1. 아레니우스 식의 로그 형태 ¶
 \left(\frac1T\right) + \ln A)
(1차함수
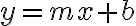
의 형태)
유도법
양변에 로그를 취하면
축
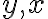
가 각각
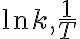
인 그래프, 감소하는 일차함수.
y절편은
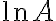
기울기는
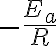
그래서 기울기에서 활성화에너지를 구할 수 있다.
두 다른 온도
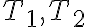
와 그 때의 속도상수
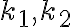
를 알고 있다면
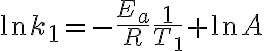

이렇게 연립방정식을 만들어서
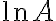
가 소거되므로 활성화에너지를 구할 수 있다.
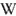 Pre-exponential_factor = A factor
Pre-exponential_factor = A factor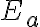 가 증가할 때 감소하고,
가 증가할 때 감소하고, 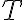 가 증가할 때 증가한다.
가 증가할 때 증가한다.
