물질,substance,matter은 원자로 이뤄진다.
원자는 입자,particle.
원자나 분자는 이온화,ionization을 거쳐 이온,ion이 됨.
다수의 원자가 모여 공유결합,covalent_bond력으로 결합되면 분자,molecule.
원자나 분자는 이온화,ionization을 거쳐 이온,ion이 됨.
다수의 원자가 모여 공유결합,covalent_bond력으로 결합되면 분자,molecule.
1. from McMurry Chemistry 6e and EBS수특2014 ¶
어떤 원자의 질량수란, 그 원자의 원자핵 내 양성자,proton 수와 중성자,neutron 수를 합한 것.
}
mass number = number of protons + number of neutrons
Up: 화학,chemistry? 원자,atom}
그리하여, 원자 표기:
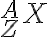


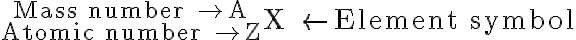
원자번호 = atomic number = Z = 양성자수
질량수 = mass number = A = 양성자수 + 중성자수
질량수 = mass number = A = 양성자수 + 중성자수
동위원소isotope
protium
deuterium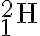
tritium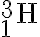
원자 번호가 같지만 원자량이 다른 원소
원자번호는 같지만 질량수가 다른 원자
(동위원자라고 안하네?)
수소,hydrogen의 동위원소,isotope들:원자번호는 같지만 질량수가 다른 원자
(동위원자라고 안하네?)
protium
deuterium
tritium
2. 구성: 원자구조 atomic structure ¶
atom은 subatomic particles로 이뤄짐. (양성자, 중성자, 전자)
원자 전체는 전기적으로 중성(neutral)이며, 전자,electron를 잃거나 얻어서 전하,electric_charge를 띠고 있을 경우엔 이온,ion이라고 부름.
A charged atom is called an ion.
A charged atom is called an ion.
주변에 음전하를 띤 전자,electron의 구름?(오비탈,orbital)
보어 모델(보어_모형,Bohr_model)에 따르면 원 궤도를 회전
제일 바깥쪽 껍질인 valence shell에 원자가전자,valence_electron (또는![[https]](/123/imgs/https.png) https://namu.wiki/w/최외각%20전자 원자가전자와 다름) 가 있음
https://namu.wiki/w/최외각%20전자 원자가전자와 다름) 가 있음
shell
orbit
원자 내 전자는 불연속적인 에너지 준위 energy level .......
원자 내 전자는 서로 독립적인 세 개의 양자수(quantum number)로 상태를 나타낼 수 있다. (n, l, m) // See 양자수,quantum_number later
제일 바깥쪽 껍질인 valence shell에 원자가전자,valence_electron (또는
![[https]](/123/imgs/https.png) https://namu.wiki/w/최외각%20전자 원자가전자와 다름) 가 있음
https://namu.wiki/w/최외각%20전자 원자가전자와 다름) 가 있음shell
orbit
원자 내 전자는 불연속적인 에너지 준위 energy level .......
원자 내 전자는 서로 독립적인 세 개의 양자수(quantum number)로 상태를 나타낼 수 있다. (n, l, m) // See 양자수,quantum_number later
n=1 lowest level : ground state, most stable
2.1. 오비탈,orbital ¶
원자오비탈 atomic orbital, AO
혼성오비탈 hybrid orbital
2s 2p ( px py pz )
3s 3p 3d ( dyz dxz dxy dx2-y2 dz2 )
전자가 원자핵 주위에 존재할 확률을 나타내는 함수
세 양자수,quantum_number(n, l, m)으로 특정됨
l=(0, 1, 2, 3)일 때 각각 s, p, d, f 오비탈임
분자오비탈 molecular orbital, MO세 양자수,quantum_number(n, l, m)으로 특정됨
l=(0, 1, 2, 3)일 때 각각 s, p, d, f 오비탈임
혼성오비탈 hybrid orbital
sp sp2 등
1s2s 2p ( px py pz )
3s 3p 3d ( dyz dxz dxy dx2-y2 dz2 )
2.2. 가리움효과 and 침투효과 ¶
가리움 효과(screening effect) ... shielding이라는 단어도 쓰는 듯?
 가리움_효과
가리움_효과
{
이걸로 인해 원자핵⇔전자 인력이 감소.
다전자원자에서 전자 간의 반발력이 원자핵과 전자의 인력을 부분적으로 상쇄시키는 효과.
{
이걸로 인해 원자핵⇔전자 인력이 감소.
다전자원자에서 전자 간의 반발력이 원자핵과 전자의 인력을 부분적으로 상쇄시키는 효과.
이 때 전자에 작용하는 원자핵의 알짜 전하량 = 유효핵전하(effective nuclear charge).
유효 핵전하(effective nuclear charge):
전자가 실질적으로 원자핵의 양성자로부터 느낄 수 있는 인력
전자가 실질적으로 원자핵의 양성자로부터 느낄 수 있는 인력
침투효과(Penetration Effect): ... penetrating
바깥쪽 껍질의 전자는 안쪽 껍질의 전자에 비해 원자핵에 그다지 속박되지 않음.
}
바깥쪽 껍질의 전자는 안쪽 껍질의 전자에 비해 원자핵에 그다지 속박되지 않음.
}
tmp from https://molecule.tistory.com/14
{
정리하면,
가려막기 효과(shielding) : s < p < d
침투 효과(penetrating) : s > p > d
그래서, 결론적으로 같은 껍질에서의 오비탈의 에너지는 s < p < d
}
{
정리하면,
가려막기 효과(shielding) : s < p < d
침투 효과(penetrating) : s > p > d
그래서, 결론적으로 같은 껍질에서의 오비탈의 에너지는 s < p < d
}
3. TODO: TOMOVE; 원자구조 moved from 화학,chemistry#s-4 ¶
양자수(quantum number, QN):
주양자수 n (principal QN)
혹은
(n, l, ml, ms)
CHK this
The Quantum Numbers
Quantum Numbers (Table 4.3, page 43, The Basics of Chemistry)
파울리_배타원리,Pauli_exclusion_principle
껍질(shell)
K, L, M, N, ...
궤도양자수 l (또는 각운동량양자수, 각운동량,angular_momentum QN)K, L, M, N, ...
버금껍질, 부껍질(subshell)
s, p, d, f, ...
오비탈의 3차원 모양을 결정함.
l = 0, 1, …, n-1
다시 말해,
l=1: p(principal)
l=2: d(diffuse)
l=3: f(fundamental)
자기양자수 ml (magnetic QN)s, p, d, f, ...
오비탈의 3차원 모양을 결정함.
l = 0, 1, …, n-1
다시 말해,
n=1이면 l=0
n=2이면 l=0, 1
n=3이면 l=0, 1, 2
l=0: s(sharp)n=2이면 l=0, 1
n=3이면 l=0, 1, 2
l=1: p(principal)
l=2: d(diffuse)
l=3: f(fundamental)
l=0이면 ml = 0
l=1이면 ml = -1, 0, +1
l=2이면 ml = -2, -1, 0, +1, +2
스핀양자수 msl=1이면 ml = -1, 0, +1
l=2이면 ml = -2, -1, 0, +1, +2
+½의 스핀은 ↑로,
-½의 스핀은 ↓로 표기
(n, l, m, s)-½의 스핀은 ↓로 표기
혹은
(n, l, ml, ms)
| ..를 결정 | 기호 | 범위 | |
| 주양자수 | 전자 껍질 | n | 1, 2, 3, ... → K, L, M, N... |
| 부양자수 | 오비탈 모양 | l | 0, 1, ..., n-1 → s, p, d, f... |
| 자기양자수 | 오비탈 방향 | m 또는 ml | -l, ..., 0, ..., +l |
| 스핀양자수 | s 또는 ms | ↑↓, ±½ |
CHK this
| n | l | ml | 오비탈 표시 |
| 1 | 0 | 0 | 1s |
| 2 | 0 | 0 | 2s |
| 2 | 1 | -1, 0, +1 | 2p |
| 3 | 0 | 0 | 3s |
| 3 | 1 | -1, 0, +1 | 3p |
| 3 | 2 | -2, -1, 0, +1, +2 | 3d |
| 4 | 0 | 0 | 4s |
| 4 | 1 | -1, 0, +1 | 4p |
| 4 | 2 | -2, -1, 0, +1, +2 | 4d |
| 4 | 3 | -3, -2, -1, 0, +1, +2, +3 | 4f |
The Quantum Numbers
| Name | Symbol | Permitted Values |
| Principal QN | ||
| Angular momentum QN | ||
| Magnetic QN | ||
| Spin QN |
Quantum Numbers (Table 4.3, page 43, The Basics of Chemistry)
| Shell | n | 가능한 l | 가능한 ml | ms | 최대 전자수 |
| K | 1 | 0 | 0 | ±½ | 2 |
| L | 2 | 0, 1 | -1, 0, 1 | ±½ | 8 |
| M | 3 | 0, 1, 2 | -2, -1, 0, 1, 2 | ±½ | 18 |
| N | 4 | 0, 1, 2, 3 | -3, -2, -1, 0, 1, 2, 3 | ±½ | 32 |
| O | 5 | 0, 1, 2, 3, 4 | -4, -3, -2, -1, 0, 1, 2, 3, 4 | ±½ | 50 |
파울리_배타원리,Pauli_exclusion_principle
쌓음원리(aufbau principle)
{
가장 낮은 에너지 궤도 함수에 전자 배치...?
}
{
가장 낮은 에너지 궤도 함수에 전자 배치...?
}
가장 안정한 전자배치,electron_configuration 관련.
In atoms with partially filled p, d, or f subshells, the electrons stay unpaired as much as possible.
(Schaum Beginning Chem p32)
(Schaum Beginning Chem p32)
축퇴된(degenerated) 오비탈,orbital은 전자들이 최대한 같은 스핀,spin으로 있을 때 가장 낮은 에너지를 가진다.
전자들은 가능한 홀전자로 있으려 하며, 같은 부껍질의 홀전자들은 같은 스핀 양자수를 가진다.
전자들은 가능한 홀전자로 있으려 하며, 같은 부껍질의 홀전자들은 같은 스핀 양자수를 가진다.
ex. 2p는 ⇵ ↑ ↑ 가 되려 함
4. CLEAN 어떤건 원소,element로 ¶
주기율표(periodic table)
족(group)
주기(period)
족(group)
주기(period)
전이원소(transition element) 3족 ~ 12족
내부전이원소(inner transition element)
전형원소(typical element)
