중성인 원소에 전자가 추가되어 -1 가 음이온이 되었을 때(음이온을 만들 때?) 필요한 에너지.
값이 음인 경우가 많은데 이때는 전자를 추가되면서 에너지를 방출.
값이 음인 경우가 많은데 이때는 전자를 추가되면서 에너지를 방출.
기체 상태의 고립된 원자에 전자를 하나 첨가할 때 일어나는 에너지 변화 .
중성 원자에 전자를 가할 때 일반적으로 에너지가 방출되기 때문에, 전자친화도는 일반적으로 음의 값을 가짐.
EA값이 더 음수일수록 원자는 전자를 받는 경향이 증가하고 그 음이온은 더 안정함.
전자를 첨가하여 불안정한 음이온을 형성하는 원자는 양수 EA값을 가짐.
중성 원자에 전자를 가할 때 일반적으로 에너지가 방출되기 때문에, 전자친화도는 일반적으로 음의 값을 가짐.
EA값이 더 음수일수록 원자는 전자를 받는 경향이 증가하고 그 음이온은 더 안정함.
전자를 첨가하여 불안정한 음이온을 형성하는 원자는 양수 EA값을 가짐.
이름에서 유도할 수 있는 쉬운 성질: 전자친화도가 큰 원소는 음이온이 되기 쉽다.
전자친화도는 전자 하나를 중성 원자에 더해서 음이온,anion을 만들어내는 데 필요하거나, 방출하는 에너지,energy를 나타낸다.
F, Cl, Br, I와 같은 할로겐족의 원자는 실제로 음이온을 만들기 위해 전자를 끌어당길 수 있다. 이러한 원자의 전자친화도는 음수이다.
Cl 원자 내에 전자 하나를 놓으면 3.6 eV만큼의 에너지가 방출된다. Cl− 이온이 Cl 원자보다 더 낮은 에너지를 갖는데, 이것은 Cl 원자 내에 전자를 줌으로써 에너지적으로 더 선호하는 Cl− 이온을 형성함을 의미한다.
(Kasap p4)
F, Cl, Br, I와 같은 할로겐족의 원자는 실제로 음이온을 만들기 위해 전자를 끌어당길 수 있다. 이러한 원자의 전자친화도는 음수이다.
Cl 원자 내에 전자 하나를 놓으면 3.6 eV만큼의 에너지가 방출된다. Cl− 이온이 Cl 원자보다 더 낮은 에너지를 갖는데, 이것은 Cl 원자 내에 전자를 줌으로써 에너지적으로 더 선호하는 Cl− 이온을 형성함을 의미한다.
(Kasap p4)
Notes 2020-11-22 ¶
전자친화도:
2차 전자친화도: 항상 양수 (정전기적 반발력을 극복해야 하므로)
1 mol의 전자를
1 mol의 기체원자나 이온에 더하는 데 수반되는 에너지 (kJ)
1차 전자친화도: 대부분 음수1 mol의 기체원자나 이온에 더하는 데 수반되는 에너지 (kJ)
2차 전자친화도: 항상 양수 (정전기적 반발력을 극복해야 하므로)
X+e→X-, ΔH=EA1
X-+e→X2-, ΔH=EA2
X-+e→X2-, ΔH=EA2
from https://youtu.be/aV9OuaFqiTY 54m
반도체 쪽에서 전자친화도의 뜻 ¶
(화학쪽과 조금 다르다)
silicon lattice에서 주변 열적 에너지를 받아서 일부 전자들이 공유결합 에너지를 깨고 탈출하면서 EHP를 만들 수 있다.
이렇게 탈출한 자유전자,free_electron에 추가적인 에너지를 가해서 자유전자를 silicon lattice 밖으로 완전히 끄집어낼 때 필요한 에너지를
electron affinity![$\chi \; [\text{V}]$ $\chi \; [\text{V}]$](/123/cgi-bin/mimetex.cgi?\Large \chi \; [\text{V}])
라고 한다.
이렇게 탈출한 자유전자,free_electron에 추가적인 에너지를 가해서 자유전자를 silicon lattice 밖으로 완전히 끄집어낼 때 필요한 에너지를
electron affinity
라고 한다.
자유전자 대부분은
(conduction_band 의 밑부분? 바닥부분?)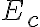 level에 있는데,
level에 있는데,
여기 있는 전자에 추가적 에너지 를 가해서
를 가해서
vacuum energy level (Si 원자핵들의 영향력이 전혀 없는 level)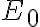 까지 도달할 수 있게 하는 게 Si의 전자친화도.
까지 도달할 수 있게 하는 게 Si의 전자친화도.
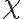 of Si : 4.01 V
of Si : 4.01 V
(conduction_band 의 밑부분? 바닥부분?)
여기 있는 전자에 추가적 에너지
vacuum energy level (Si 원자핵들의 영향력이 전혀 없는 level)
from 김성호 https://youtu.be/EqIAv2eCxeo?t=311


![[https]](/123/imgs/https.png)