화학 반응 속도
기호:
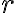 (rate에서 유래한 듯)
(rate에서 유래한 듯)
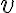
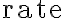
화학 반응의 빠르고 느린 정도
(반응속도)
![$\textrm{rate}=-\frac{\Delta [\textrm{A}]}{\Delta t}=k[{\rm A}]^m[{\rm B}]^n$ $\textrm{rate}=-\frac{\Delta [\textrm{A}]}{\Delta t}=k[{\rm A}]^m[{\rm B}]^n$](/123/cgi-bin/mimetex.cgi?\Large \textrm{rate}=-\frac{\Delta [\textrm{A}]}{\Delta t}=k[{\rm A}]^m[{\rm B}]^n)
= (반응물질의 농도 감소량) / (시간의 변화)
= (생성물질의 농도 증가량) / (시간의 변화)
Rate= (생성물질의 농도 증가량) / (시간의 변화)
= ΔC / Δt [M/s]
반응속도(reaction rate)= Δ(concentration) / Δt
단위:
{
단위 시간,time당 생성물의 농도,concentration 증감
![$\pm\frac{\Delta [{\rm A}]}{\Delta t}$ $\pm\frac{\Delta [{\rm A}]}{\Delta t}$](/123/cgi-bin/mimetex.cgi?\Large \pm\frac{\Delta [{\rm A}]}{\Delta t})
반응속도는 편의상 항상 양으로 함. (반응물일 경우 음의 부호,sign를 붙임, 생성물일 경우 붙이지 않음)
여기에 각 성분의 반응식에서의 계수로 나누어 줌. (성분마다 반응 속도가 다르게 정의되면 불편하므로?)
}
M/s (초당 몰,mole이 아니고, 초당 몰농도,molarity임에 주의)
mol/(L·s), mol L-1 s-1
CHK CLEANUPmol/(L·s), mol L-1 s-1
1 M = 1 mol/L 이므로, 1 M/s = 1 mol/L·s
{
단위 시간,time당 생성물의 농도,concentration 증감
여기에 각 성분의 반응식에서의 계수로 나누어 줌. (성분마다 반응 속도가 다르게 정의되면 불편하므로?)
}
물질의 반응속도에 영향을 미치는 요인 ¶
농도,concentration (반응물들의)
등
반응하려면 충돌해야 하고, 그러려면 서로 만나야 함.
온도,temperature (반응이 일어나는)반응하기 위해서는 충분한 에너지를 가지고 충돌해야 함.
반응물의 물리적 상태 physical state (섞여 있는지, 잘 섞여 있는지 등)균일(homogeneous)반응 : 반응물이 모두 기체 or 모두 액체
불균일(heterogeneous)반응 : 반응물에 서로 다른 상, 반응물이 접촉하는 부분에서 반응이 일어남
표면적
촉매,catalyist불균일(heterogeneous)반응 : 반응물에 서로 다른 상, 반응물이 접촉하는 부분에서 반응이 일어남
표면적
등
반응식 계수 혹은 화학량론과의 관계 ¶
간단한 반응을 예로 들면,
![$\textrm{rate}=-\frac12\frac{\Delta[{\rm A}]}{\Delta t}$ $\textrm{rate}=-\frac12\frac{\Delta[{\rm A}]}{\Delta t}$](/123/cgi-bin/mimetex.cgi?\Large \textrm{rate}=-\frac12\frac{\Delta[{\rm A}]}{\Delta t})
![$\textrm{rate}=\frac{\Delta [{\rm B}]}{\Delta t}$ $\textrm{rate}=\frac{\Delta [{\rm B}]}{\Delta t}$](/123/cgi-bin/mimetex.cgi?\Large \textrm{rate}=\frac{\Delta [{\rm B}]}{\Delta t})
일반화하면,
aA+bB→cC+dD 에서,
![$-\frac{\Delta[{\rm A}]}{a}=-\frac{\Delta[{\rm B}]}{b}=\frac{\Delta[{\rm C}]}{c}=\frac{\Delta[{\rm D}]}{d}$ $-\frac{\Delta[{\rm A}]}{a}=-\frac{\Delta[{\rm B}]}{b}=\frac{\Delta[{\rm C}]}{c}=\frac{\Delta[{\rm D}]}{d}$](/123/cgi-bin/mimetex.cgi?\Large -\frac{\Delta[{\rm A}]}{a}=-\frac{\Delta[{\rm B}]}{b}=\frac{\Delta[{\rm C}]}{c}=\frac{\Delta[{\rm D}]}{d})
이고 양변을 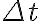 로 나누면
로 나누면
![$\text{rate}=\frac{\Delta[\textrm{C}]}{c\Delta t}=\frac{\Delta[\textrm{D}]}{d\Delta t}=\frac{-\Delta[\textrm{A}]}{a\Delta t}=\frac{-\Delta[\textrm{B}]}{b\Delta t}$ $\text{rate}=\frac{\Delta[\textrm{C}]}{c\Delta t}=\frac{\Delta[\textrm{D}]}{d\Delta t}=\frac{-\Delta[\textrm{A}]}{a\Delta t}=\frac{-\Delta[\textrm{B}]}{b\Delta t}$](/123/cgi-bin/mimetex.cgi?\Large \text{rate}=\frac{\Delta[\textrm{C}]}{c\Delta t}=\frac{\Delta[\textrm{D}]}{d\Delta t}=\frac{-\Delta[\textrm{A}]}{a\Delta t}=\frac{-\Delta[\textrm{B}]}{b\Delta t})
See also 화학량론,stoichiometry
2A → B
에서는 반응물 A가 2몰 없어질때마다 생성물 B가 1몰 생기므로 rate는 두 식으로 표현할 수 있다.aA+bB→cC+dD 에서,
반응속도식 rate equation ¶
ex.
반응식 aA+bB→cD+dD 에서 반응속도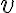 는
는
![$v=k [{\rm A}]^m [{\rm B}]^n$ $v=k [{\rm A}]^m [{\rm B}]^n$](/123/cgi-bin/mimetex.cgi?\Large v=k [{\rm A}]^m [{\rm B}]^n)
여기서
 반응속도상수, 반응물의 농도와 무관, 온도에 의해 변함 (See 속도상수,rate_constant)
반응속도상수, 반응물의 농도와 무관, 온도에 의해 변함 (See 속도상수,rate_constant)
 반응차수(individual reaction order)
반응차수(individual reaction order)
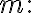 A에 대한 반응차수
A에 대한 반응차수
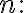 B에 대한 반응차수
B에 대한 반응차수
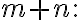 전체반응차수(overall reaction order)
전체반응차수(overall reaction order)
ex. 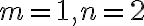 이면, 반응은 (the reaction is)
이면, 반응은 (the reaction is)
1차 반응 반응속도식은 v=k[A]
2차 반응
반응식 aA+bB→cD+dD 에서 반응속도
A에 대해 1차 (first-order in A)
B에 대해 2차 (second-order in B)
전체에 대해 3차 (third-order overall)
0차 반응 반응속도식은 v=k[A]0=kB에 대해 2차 (second-order in B)
전체에 대해 3차 (third-order overall)
1차 반응 반응속도식은 v=k[A]
2차 반응
반응식이 aA + bB → cC + dD 일 때, 반응속도 v는
![$v=-\frac1a \frac{d[{\rm A}]}{dt}=-\frac1b \frac{d[{\rm B}]}{dt} = \frac1c \frac{d[{\rm C}]}{dt} = \frac1d \frac{d[{\rm D}]}{dt}$ $v=-\frac1a \frac{d[{\rm A}]}{dt}=-\frac1b \frac{d[{\rm B}]}{dt} = \frac1c \frac{d[{\rm C}]}{dt} = \frac1d \frac{d[{\rm D}]}{dt}$](/123/cgi-bin/mimetex.cgi?\Large v=-\frac1a \frac{d[{\rm A}]}{dt}=-\frac1b \frac{d[{\rm B}]}{dt} = \frac1c \frac{d[{\rm C}]}{dt} = \frac1d \frac{d[{\rm D}]}{dt})
반응이 일어날 경우 각 물질의 시간당 몰수변화가 모두 다른데, 이것은 하나의 반응에 대해서 반응속도를 하나로 통일하기 위해 각 물질의 계수(?)로 나눈 것임.
aA+bB→cC 의 반응속도식은 일반적으로
v=k[A]m[B]n

