구성 입자들의 운동에너지,kinetic_energy와 퍼텐셜에너지,potential_energy의 총합.
계,system의 모든 입자,particle들의 운동에너지와 퍼텐셜에너지의 합.
어떤 계 안의 입자들이 가진 운동 에너지와 위치 에너지의 합.
계,system의 모든 입자,particle들의 운동에너지와 퍼텐셜에너지의 합.
어떤 계 안의 입자들이 가진 운동 에너지와 위치 에너지의 합.
기호 U, 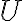
계의 내부 에너지는 보통 알 수 없고, 계가 변화를 겪을 때 일어나는 "내부 에너지의 변화"가 중요하다.
계의 내부 에너지는 보통 알 수 없고, 계가 변화를 겪을 때 일어나는 "내부 에너지의 변화"가 중요하다.
이상기체,ideal_gas의 경우, 입자들 간 상호작용이 없으므로, 구성 입자들의 운동에너지,kinetic_energy의 합이 곧 내부에너지.
통계역학,statistical_mechanics적으로 표현하면, 내부에너지는 그 계의 총 에너지의 앙상블 평균(ensemble average). (See 앙상블,ensemble)
열역학,thermodynamics적으로 기술하면, 내부에너지는 열역학적 계의 중요한 상태함수,state_function들 중 하나. (See also 열역학퍼텐셜,thermodynamic_potential)
통계역학,statistical_mechanics적으로 표현하면, 내부에너지는 그 계의 총 에너지의 앙상블 평균(ensemble average). (See 앙상블,ensemble)
열역학,thermodynamics적으로 기술하면, 내부에너지는 열역학적 계의 중요한 상태함수,state_function들 중 하나. (See also 열역학퍼텐셜,thermodynamic_potential)
내부에너지변화 changes in internal energy ¶
내부에너지는 일이나 열에 따라 변할 수 있음
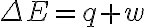
여기서
에너지가 계와 주위 사이에서 교환될 때, 열(q) 또는 일(w)의 형태로 교환됨. 즉,
화학 관점임 CHK
에너지가 계와 주위 사이에서 교환될 때, 열(q) 또는 일(w)의 형태로 교환됨. 즉,
ΔE = q + w
ΔE, q, w의 부호 규약| +는 | -는 | |
| q에 대해 | 계가 열을 얻음을 의미 | 계가 열을 잃음을 의미 |
| w에 대해 | 계에 대해 수행된 일을 의미 | 계에 의해 수행된 일을 의미 |
| ΔE에 대해 | 계에 의한 에너지의 순획득을 의미 | 계에 의한 에너지의 순손실을 의미 |
부호,sign는 상식적으로 정의됨.
| ΔE > 0 | Einitial < Efinal | 계가 주위에서 에너지를 흡수 | endergonic |
| ΔE < 0 | Einitial > Efinal | 계는 주위로 에너지를 방출 | exergonic |
피스톤 단면적 A
피스톤에 작용하는 기체의 압력 P
기체가 피스톤에 작용하는 힘 F
일 때, 압력,pressure의 정의에 의해
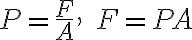
피스톤이 힘 F에 의해 s만큼 밀려날 때 기체가 한 일,work W는
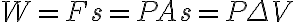
여기서 ΔV는 부피 변화
피스톤에 작용하는 기체의 압력 P
기체가 피스톤에 작용하는 힘 F
일 때, 압력,pressure의 정의에 의해
물리와 화학에서 부호를 다르게 정의하는 항이 있어서 골치아픔. 다음 페이지 참조.
http://www.ktword.co.kr/test/view/view.php?m_temp1=1949&id=1176
http://www.ktword.co.kr/test/view/view.php?m_temp1=1949&id=1176
계가 받은 일은 계의 부피 변화와 관련이 있다.
계의 부피가 줄어들면 계가 일을 받은 것이고(w>0),
계의 부피가 늘어나면 계가 주위에 일을 한 것이다(w<0).
계의 부피가 줄어들면 계가 일을 받은 것이고(w>0),
계의 부피가 늘어나면 계가 주위에 일을 한 것이다(w<0).
내부 에너지(U) 변화량(ΔU)은 계로 들어온 열(q)과 계에 행해진 일(w)의 합과 같다.
tmp from ebs 장인수
이상기체를 가정.
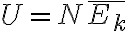 (내부에너지는, 이상기체분자들의 총 운동에너지의 합)
(내부에너지는, 이상기체분자들의 총 운동에너지의 합)
) (운동에너지는 3/2kT)
(운동에너지는 3/2kT)
)
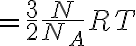
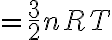
따라서
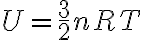
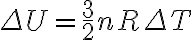
아울러  이므로
이므로
)
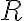 : 기체상수,gas_constant
: 기체상수,gas_constant
 : 볼츠만_상수,Boltzmann_constant
: 볼츠만_상수,Boltzmann_constant
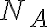 : 아보가드로수,Avogadro_constant
: 아보가드로수,Avogadro_constant


![[https]](/123/imgs/https.png)