기호 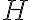
'열함량' 정도
특정 온도와 압력에서, 어떤 물질이 가지는 고유한 에너지 함량.
특정 온도,temperature와 압력,pressure에서, 어떤 물질,substance,matter이 가지는 고유한 에너지,energy 함량.
열역학적 상태함수,state_function의 하나로, 계가 어떤 열역학적 상태(thermodynamic state)에서 지니고 있는 열에너지.
그 계가 지닌 열에너지의 총량.
특정 온도,temperature와 압력,pressure에서, 어떤 물질,substance,matter이 가지는 고유한 에너지,energy 함량.
열역학적 상태함수,state_function의 하나로, 계가 어떤 열역학적 상태(thermodynamic state)에서 지니고 있는 열에너지.
그 계가 지닌 열에너지의 총량.
크기성질임. (소비된 반응물 양에 정비례)
정의:
엔탈피 변화 시 발열, 흡열
H = E + PV
엔탈피 = 내부에너지 + 압력 × 부피
H = U + PV
엔탈피(H)는 내부에너지(U)에 압력(P)와 부피(V)의 곱을 더한 것. (이 셋은 모두 상태함수임)
U : 내부에너지,internal_energy
물리학백과:엔탈피 = 내부에너지 + 압력 × 부피
H = U + PV
엔탈피(H)는 내부에너지(U)에 압력(P)와 부피(V)의 곱을 더한 것. (이 셋은 모두 상태함수임)
U : 내부에너지,internal_energy
H = U + pV
여기서H : 계의 엔탈피
U : 계의 내부에너지,internal_energy
p : 계의 압력,pressure
V : 계의 부피,volume
pV : 계가 외부에 대한 일,work의 양
밀접: 화학 반응에서의 열,heatU : 계의 내부에너지,internal_energy
p : 계의 압력,pressure
V : 계의 부피,volume
pV : 계가 외부에 대한 일,work의 양
엔탈피 변화 시 발열, 흡열
보통 직접 측정할 수 없고, 화학 반응에서 열의 변화(출입하는 열에너지)를 통해 간접적으로 측정
// tmp from 물리학백과
{
절대적인 엔탈피 값(본문엔 '엔탈피의 절댓값'이라 하나 이는 abs(H) 랑 혼돈의 여지가 있을 것 같은?)
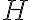
는 실험으로 측정할 수 없으나, 열역학적 퍼텐셜에너지,potential_energy(열역학퍼텐셜,thermodynamic_potential)의 한 종류이므로, 어떤 기준점을 임의로 설정하고 그 기준점으로부터의 차이,difference
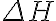
가 물리적으로 의미가 있다.
}
// tmp from 물리학백과
{
절대적인 엔탈피 값(본문엔 '엔탈피의 절댓값'이라 하나 이는 abs(H) 랑 혼돈의 여지가 있을 것 같은?)
}
반응 엔탈피 (enthalpy of reaction) = 반응열 (heat of reaction) ΔH, ΔHrxn 반응열,heat_of_reaction
물의 융해 엔탈피 : 얼음이 녹음 : 열을 흡수 : ΔH융해 > 0
연료의 연소 엔탈피 : 열을 발생(방출) : ΔH연소 < 0
관련 반응을 명시해야 함 (단어 의미상 당연히)
ΔH > 0 : 엔탈피 증가 : 반응이 흡열반응 : 불안정해짐 - 비자발적인 경우가 많음
정반응의 ΔH와 역반응의 ΔH는 크기는 같고 부호,sign는 반대
쉬운 예물질 상태도 명시해야 함 (ex. 생성물이 (g)인지 (ℓ)인지에 따라 당연히 값이 달라짐)
ΔH < 0 : 엔탈피 감소 : 반응이 발열반응 : 안정해짐 - 자발적인 경우가 많음ΔH > 0 : 엔탈피 증가 : 반응이 흡열반응 : 불안정해짐 - 비자발적인 경우가 많음
정반응의 ΔH와 역반응의 ΔH는 크기는 같고 부호,sign는 반대
물의 융해 엔탈피 : 얼음이 녹음 : 열을 흡수 : ΔH융해 > 0
연료의 연소 엔탈피 : 열을 발생(방출) : ΔH연소 < 0
주의할 점 ![[http]](/123/imgs/http.png) src
src
1. 엔탈피 값은 압력, 온도에 따라 다르다.
따라서 기준 상태를 정해주는 것이 중요하다. 표준상태란 1 atm, 25 °C 일 때를 말한다. 표준상태에서의 엔탈피를 표준엔탈피라 하고, H°로 표시한다.
![[http]](/123/imgs/http.png) src
src1. 엔탈피 값은 압력, 온도에 따라 다르다.
따라서 기준 상태를 정해주는 것이 중요하다. 표준상태란 1 atm, 25 °C 일 때를 말한다. 표준상태에서의 엔탈피를 표준엔탈피라 하고, H°로 표시한다.
2. 엔탈피는 상태함수이다.
(상태함수: 계가 특정 상태에 있으면 어떤 경로를 통해 그 상태에 도달하였는지 상관없는 성질)
(경로함수: 어떤 과정을 거치는지에 따라 값이 달라지는 성질)
참고로 열(q), 일(w)은 경로함수지만, 그 합인 내부에너지변화(ΔE)는 상태함수로서, 경로에 상관없이 같다.
(상태함수: 계가 특정 상태에 있으면 어떤 경로를 통해 그 상태에 도달하였는지 상관없는 성질)
(경로함수: 어떤 과정을 거치는지에 따라 값이 달라지는 성질)
참고로 열(q), 일(w)은 경로함수지만, 그 합인 내부에너지변화(ΔE)는 상태함수로서, 경로에 상관없이 같다.
3. 엔탈피는 세기성질이다.
(세기성질: 크기가 물질의 양에 비례하는 성질)
(크기성질: 물질의 양이 변해도 크기에 변화가 없는 성질 ex. 밀도)
(세기성질: 크기가 물질의 양에 비례하는 성질)
(크기성질: 물질의 양이 변해도 크기에 변화가 없는 성질 ex. 밀도)
ttttmp
http://www.sciencenanum.net/chemistry/condensed.html
http://www.sciencenanum.net/chemistry/thermochem.html
http://www.sciencenanum.net/chemistry/thermochem/thermochem_05.html
http://www.sciencenanum.net/chemistry/condensed.html
http://www.sciencenanum.net/chemistry/thermochem.html
http://www.sciencenanum.net/chemistry/thermochem/thermochem_05.html
1. from ebs; to merge ¶
엔탈피(H): 일정한 압력에서, 어떤 물질이 가지고 있는 고유한 총 에너지 함량
절대값을 정확하게 측정하는 것은 불가능하지만 반응열을 측정하면 물질이 가진 엔탈피의 차이를 알 수 있음
일정 압력에서 열의 출입은 엔탈피의 변화(ΔH)
반응열(Q): ΔH와 절대값은 같고 부호는 반대
반응엔탈피(ΔH)
= (생성물질의 총 엔탈피) - (반응물질의 총 엔탈피)
= ΣH(생성물질) - ΣH(반응물질)
생성엔탈피= ΣH(생성물질) - ΣH(반응물질)
: 어떤 물질 1몰이 성분 원소의 가장 안정한 원소로부터 생성될 때의 반응엔탈피
표준생성엔탈피: 1기압에서의 생성엔탈피
단위 kJ/mol다른 모든 enthalpy도 마찬가지??
반응엔탈피/분해엔탈피: 어떤 물질 1몰이 가장 안정한 성분 원소로 분해될 때의 반응엔탈피
생성엔탈피와 절대값 같고 부호 반대반응엔탈피/연소엔탈피
: 어떤 물질 1몰이 완전연소하여 가장 안정한 생성물이 될 때의 반응엔탈피
연소반응은 항상 발열반응이므로, 연소엔탈피(ΔH)는 항상 (-)값반응엔탈피/중화엔탈피
: 산의 H+(aq) 1몰과 염기의 OH-(aq) 1몰이 중화반응하여 1몰의 H2O(l)이 생성될 때의 반응엔탈피
중화엔탈피는 반응하는 산과 염기의 종류에 관계 없이 일정
related: 알짜이온반응식
반응엔탈피/용해엔탈피중화엔탈피는 반응하는 산과 염기의 종류에 관계 없이 일정
related: 알짜이온반응식
: 어떤 물질 1몰이 다량의 물에 용해될 때의 반응엔탈피
(EBS)2. from zum; to merge ¶
엔탈피
반응열 : 반응물의 엔탈피 합에서 생성물의 엔탈피 합을 뺀 값
Up: 열,heat
표준엔탈피 H°
반응열(Q)과 반응엔탈피(ΔH)25 ℃, 1기압에서의 엔탈피 값
반응엔탈피 ΔH일정한 압력에서, 화학 반응이 일어날 때의 엔탈피 변화
반응엔탈피 = 생성물의 엔탈피 합 - 반응물의 엔탈피 합
ΔH = ΣH생성물 - ΣH반응물
반응엔탈피 = 생성물의 엔탈피 합 - 반응물의 엔탈피 합
ΔH = ΣH생성물 - ΣH반응물
반응열 : 반응물의 엔탈피 합에서 생성물의 엔탈피 합을 뺀 값
Q = ΣH반응물 - ΣH생성물
반응열 = (반응물의 엔탈피 합) - (생성물의 엔탈피 합)
일정한 압력에서, 반응열(Q)과 반응엔탈피(ΔH)는 부호 반대임반응열 = (반응물의 엔탈피 합) - (생성물의 엔탈피 합)
Q = -ΔH
| 반응열 | 반응엔탈피 | |||
| 발열반응 | Q>0 | ΔH<0 | 반응물보다 생성물이 더 안정함 | 주위 온도가 올라감 |
| 흡열반응 | Q<0 | ΔH>0 | 생성물보다 반응물이 더 안정함 | 주위 온도가 내려감 |
4. 엔탈피 변화 (AKA 반응엔탈피) ΔH ¶
엔탈피 변화(ΔH) = (생성 물질의 엔탈피) - (반응 물질의 엔탈피)
ΔH = ΔE + Δ(PV)
P-V일 이외의 다른 일이 관여하지 않는다면 ΔE = Q - PΔV이므로
ΔH = Q + VΔP
여기서 Δ(PV) = (PΔV + VΔP) 이므로,
ΔH = ΔE + PΔV + VΔP - how? CHKP-V일 이외의 다른 일이 관여하지 않는다면 ΔE = Q - PΔV이므로
ΔH = Q + VΔP
관련: 헤스_법칙,Hess_law
반응엔탈피(ΔH) = 엔탈피변화(ΔH)
= (생성물의 엔탈피 합) - (반응물의 엔탈피 합)
= ΣH생성물 - ΣH반응물
= ΣH생성물 - ΣH반응물
| 발열 반응 | 발열과정 exothermic | ΣH반응물 > ΣH생성물 | ΔH<0 | 계의 엔탈피 감소 | 주위의 엔탈피 증가 |
| 흡열 반응 | 흡열과정 endothermic | ΣH반응물 < ΣH생성물 | ΔH>0 | 계의 엔탈피 증가 | 주위의 엔탈피 감소 |
6. 표준 반응 엔탈피 ΔH°r ¶
ΔH°r
1기압 하에서 일어나는 반응의 엔탈피 변화량
1기압 하에서 일어나는 반응의 엔탈피 변화량
표준 반응 엔탈피 = (생성물의 표준 생성 엔탈피 합) - (반응물의 표준 생성 엔탈피 합)
7. 표준 생성 엔탈피 (AKA 표준생성열) standard enthalpy of formation ΔH°f ¶
기호: 여기서 문자를 위아래로 wiki syntax로 쓰는 방법이 없는데 ( 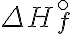 는 되지만 )
는 되지만 )
ΔH°f 인가,
ΔHf° 인가?
°(degree)인가 0(superscript zero)인가?
ΔH°f 인가,
ΔHf° 인가?
°(degree)인가 0(superscript zero)인가?
1기압에서 어떤 화합물 1몰이 그 화합물을 구성하고 있는 성분 원소의 가장 안정한 상태에서 생성될 때의 반응 엔탈피
1 atm에서, 각 원소로부터 1 mol의 화합물을 생성할 때 열의 변화
- °: 표준상태(1 atm)의 조건이라는 뜻
- f: 생성(formation)을 뜻함
엔탈피 표현식에서 기준점(0 kJ/mol) 역할을 하는듯..........CHK
ΔHf°(C, 흑연) = 0
ΔHf°(C, 다이아몬드) = 1.90 kJ/mol
ΔHf°(C, 다이아몬드) = 1.90 kJ/mol
ΔH반응° = ΣΔHf°(생성물) - ΣΔHf°(반응물)
ex. 반응식이 a A + b B → c C + d D 일 경우
ΔH반응° = (c ΔHf°(C) + d ΔHf°(D)) - (a ΔHf°(A) + b ΔHf°(B))
ΔH반응° = (c ΔHf°(C) + d ΔHf°(D)) - (a ΔHf°(A) + b ΔHf°(B))
7.1. ΔHf°를 구하는 두 방법 ¶
1. 직접법
: 원소로부터 쉽게 합성할 수 있는 화합물의 반응 엔탈피에서 구함
: 원소로부터 쉽게 합성할 수 있는 화합물의 반응 엔탈피에서 구함
ex. 이산화탄소의 생성엔탈피는, 표준상태 흑연과 산소분자가 표준상태의 이산화탄소로 될 때의 반응엔탈피
C(흑연) + O2(g) → CO2(g) ..... ΔH반응° = -393.5 kJ/mol
ΔHf°(C, 흑연) = ΔHf°(O2, g) = 0 (이 둘은 안정하므로)
ΔH반응° = ΔHf°(CO2, g) - (ΔHf°(C, 흑연) + ΔHf°(O2, g)) = -393.5 kJ/mol
ΔHf°(CO2, g) = -393.5 kJ/mol
ΔHf°(C, 흑연) = ΔHf°(O2, g) = 0 (이 둘은 안정하므로)
ΔH반응° = ΔHf°(CO2, g) - (ΔHf°(C, 흑연) + ΔHf°(O2, g)) = -393.5 kJ/mol
ΔHf°(CO2, g) = -393.5 kJ/mol
.......너무 잡다한 것을 적은 듯..........
2. 간접법
: 많은 화합물은 원소로부터 직접 합성 불가: 헤스의 법칙으로 계산
: 많은 화합물은 원소로부터 직접 합성 불가: 헤스의 법칙으로 계산
See 헤스_법칙,Hess_law
8. 결합엔탈피 bond enthalpy ¶
BE, ΔHB
기체상에서 결합 1몰이 끊어질 때 일어나는 엔탈피의 변화 CHK
기체상에서 결합 1몰을 끊기 위해 필요한 에너지 = 결합 해리 에너지
기체상에서 결합 1몰을 끊기 위해 필요한 에너지 = 결합 해리 에너지
기체 분자 1 mol에서, 특정 결합을 끊을 때 필요한 엔탈피 변화량
H2(g) → H(g) + H(g) .... ΔH° = 436.4 kJ
H2(g) → H(g) + H(g) .... ΔH° = 436.4 kJ
결합엔탈피는
단일결합 < 이중결합 < 삼중결합
평균결합엔탈피 (다원자 분자 결합에 대해) 가 있음반응엔탈피를 평균결합엔탈피로 추정 가능
ΔH° = Σ BE(반응물) - Σ BE(생성물)
= (투입된 전체 에너지) - (방출한 전체 에너지)
9. 반응엔탈피 enthalpy of reaction ¶
반응열과 같은건가 아님 부호반대인가??????
기호: ΔH, ΔHrxn (rxn = reaction)
반응엔탈피 = ΣH생성물 - ΣH반응물
ΔH = 일정 압력 하에서 반응 중에 방출하거나 흡수하는 열
흡열반응
0 °C, 1 atm에서 얼음 1 mol이 녹아 물이 될때
0 °C, 1 atm에서 얼음 1 mol이 녹아 물이 될때
H2O(s) → H2O(l)
ΔH = 6.01 kJ/mol
(계가 열을 흡수) = (흡열) = (ΔH > 0)ΔH = 6.01 kJ/mol
발열반응
0 °C, 1 atm에서 물 1 mol이 얼음이 될때
0 °C, 1 atm에서 물 1 mol이 얼음이 될때
H2O(l) → H2O(s)
ΔH = -6.01 kJ/mol
(계가 열을 방출) = (발열) = (ΔH < 0)ΔH = -6.01 kJ/mol
다음 반응물/생성물 앞뒤가 반대임에 주의!
결합에너지로 구하는 방법
ΔH반응 = Σ 반응물결합E - Σ 생성물결합E
표준생성엔탈피로 구하는 방법ΔH반응 = Σ ΔHf°(생성물) - Σ ΔHf°(반응물)
from https://youtu.be/E0UobzUe8Jc 30m어원: 그리스어 enthalpein(따뜻하게 함)에서


![[https]](/123/imgs/https.png)