현재 Gibbs만 적었는데, Gibbs / Helmholtz 분리예정
깁스_자유에너지,Gibbs_free_energy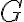
헬름홀츠_자유에너지,Helmholtz_free_energy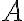
(이 둘은 열역학퍼텐셜,thermodynamic_potential.)
깁스_자유에너지,Gibbs_free_energy
헬름홀츠_자유에너지,Helmholtz_free_energy
(이 둘은 열역학퍼텐셜,thermodynamic_potential.)
깁스 자유 에너지는 일정한 압력과 온도를 유지하는 조건 아래에 있는 열역학적 계에서 뽑아낼 수 있는 유용한 에너지의 양을 나타냄
헬름홀츠 자유 에너지는 일정한 온도를 유지하는 조건 아래에 있는 열역학적 계에서 뽑아낼 수 있는 유용한 에너지의 양을 나타냄
헬름홀츠 자유 에너지는 일정한 온도를 유지하는 조건 아래에 있는 열역학적 계에서 뽑아낼 수 있는 유용한 에너지의 양을 나타냄
나타냄: 정확히 같다는 뜻? 아님 비례성?
// tmp from https://terms.naver.com/entry.naver?docId=4389746&cid=60217&categoryId=60217 여기 물리학백과 엔트로피 중간쯤
자발성 예측을 위한 함수로는 ΔSuniv 말고도 자유에너지 G가 있다. 특히 자발성의 온도 의존성을 다루는 데 유용.
기호 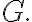
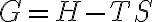
일정한 온도에서 일어나는 과정에서 (그래서 T 앞에만 Δ 없는듯)
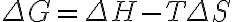
위 식을 변형해본다.
이하 sys=system=계, surr=surroundings=주위, univ=universe=우주.
G는 Gibbs에서.
정의:이하 sys=system=계, surr=surroundings=주위, univ=universe=우주.
양변을 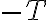 로 나누면
로 나누면
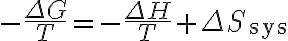
여기에 '주위 엔트로피 변화' 식 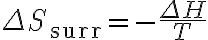 를 적용하면
를 적용하면
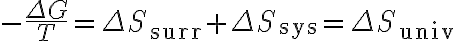
따라서
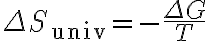 (일정 온도 및 압력에서)
(일정 온도 및 압력에서)
그래서 저 식에서
자발적 과정은 자유에너지가 감소하는 과정임
| ΔG < 0 | ΔS우주 > 0 | 과정이 자발적 |
자발적 과정은 자유에너지가 감소하는 과정임
links ko ¶
깁스 자유에너지에 대해 (심각한 글 아니고 가벼운 essay, 2006)
https://blog.naver.com/cwhaha/70003532714
{
엔트로피,entropy 한차원 위의 개념임.
(등온 등압 조건일 때) 한 계에서의 엔트로피 변화와, 그 주변의 엔트로피 변화를 모아서, 관심을 갖는 계에 대한 상태함수,state_function로 표현한 것이 Gibbs 자유에너지.
}
https://blog.naver.com/cwhaha/70003532714
{
엔트로피,entropy 한차원 위의 개념임.
(등온 등압 조건일 때) 한 계에서의 엔트로피 변화와, 그 주변의 엔트로피 변화를 모아서, 관심을 갖는 계에 대한 상태함수,state_function로 표현한 것이 Gibbs 자유에너지.
}

